Een 54-jarige patiënt werd na een endoscopische submucosale dissectie (ESD) voor een T1bN0 maagcarcinoom verwezen voor een second opinion om verdere behandelopties te bespreken. Histopathologisch onderzoek van het resectiepreparaat na de ESD toonde een slecht gedifferentieerd adenocarcinoom, met lymfangio-invasieve groei en < 1 mm marge tot de snijrand. De tumor werd gestadieerd als een T1b (sm2)-tumor, met 25-30% kans op lymfekliermetastasen. De Nederlandse maagcarcinoom-richtlijn volgend, in lijn met de Japanse richtlijn, werd in het verwijzende ziekenhuis een totale gastrectomie met D2 lymfadenectomie voorgesteld als verdere behandeling. De patiënt had echter een sterke wens om zijn maag te behouden en kwam voor een second opinion naar ons centrum met de vraag of er een maagsparende behandeling mogelijk was.
Een gastroscopie in ons centrum toonde geen aanwijzingen voor een lokale resttumor of synchrone afwijkingen elders in de maag. Het ESD-litteken met clips (figuur 1A en 1B) bevond zich aan de grote curvatuur, 6 cm distaal van de cardia. Bij EUS waren er geen verdachte lymfeklieren.
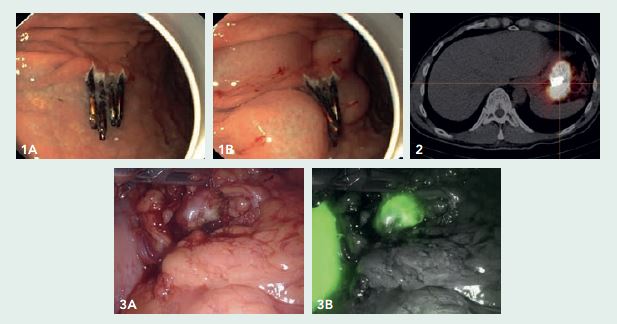
In ons centrum werd in het multidisciplinaire overleg besloten om een robot-geassisteerde sentinel node-procedure uit te voeren. Mocht de sentinel node negatief zijn, dan zou er alleen een regionale lymfeklierdissectie (in het bijbehorende arteriële stroomgebied) worden uitgevoerd. Mocht de sentinel node positief zijn, dan zou er een gastrectomie met D2 lymfadenectomie worden verricht. De dag voor de operatie onderging de patiënt een gastroscopie waarbij een ‘dual-tracer’, bestaande uit Technetium-99m en Indocyanine-groen, in 4 kwadranten om het oude ESD-litteken werd ingespoten (figuur 1A en B). Na 15 minuten en na 2 uur werd er een scintigrafie gemaakt. Hierop kon geen sentinel node worden geïdentificeerd (figuur 2), alleen het injectiegebied lichtte op.
De dag erna onderging de patiënt een robot-geassisteerde sentinel node-procedure, waarbij met de ‘Firefly’-camera en een gamma-probe 5 groene en ‘hete’ lymfeklieren werden gevonden. Vriescoupes toonde de aanwezigheid van metastase in één vergrote, bolronde lymfeklier (figuur 3A-B). Deze lymfeklier bevond zich ter plaatse van de distale arteria lienalis (lymfeklierstation 11d). Aansluitend werd een resectie verricht. Met behulp van ICG-fluorescentie kon het oude ESD-litteken mooi gevisualiseerd worden en lukte het om een partiële (in plaats van totale) maagresectie uit te voeren. In het gastrectomiepreparaat werd geen resttumor aangetoond en alle 32 niet-sentinel nodes waren negatief voor maligniteit.
Amsterdam UMC, locatie AMC: drs. A.B.J. Borgstein, arts-onderzoeker, dr. W.J. Eshuis, chirurg en prof. dr. M.I. van Berge Henegouwen, chirurg.
St Antonius ziekenhuis Nieuwegein: prof. dr. B.L.A.M. Weusten, MDL-arts.
Commentaar Jacques Bergman
De behandeling van submucosale carcinomen in de tractus digestivus staat ter discussie. Besloten we vroeger om bij submucosale uitbreiding in een EMR/ESD-preparaat altijd het rest-orgaan met omgevende lymfeklieren te verwijderen, tegenwoordig ligt die besluitvorming genuanceerder. De keuze wordt enerzijds bepaald door welke risicofactoren er in het EMR/ESD-preparaat worden aangetroffen, waarbij de radicaliteit van de verticale marge, differentiatiegraad van de tumor, lymfangio-invasie en diepte van submucosale uitbreiding van belang zijn. Anderzijds speelt de comorbiditeit van de patiënt en aard van de aanvullende resectie een rol. Voor rectum, slokdarm en proximale maag is een chirurgische resectie een grote ingreep en is een afwachtend beleid eerder gerechtvaardigd dan voor afwijkingen in de distale maag of colon waar resectie eenvoudiger en minder invaliderend is. Leidende factor is de kans op lokale lymfekliermetastasering en de wijze waarop we dit betrouwbaar kunnen aantonen dan wel uitsluiten. De combinatie van EUS en sentinel node-procedures zoals hier beschreven kan hierbij een rol spelen. Endoscopische en EUS follow-up elke 3 maanden zoals bij geselecteerde patiënten in rectum en slokdarm in studieverband geschiedt, zijn andere opties. De winst die de patiënt behaalt, is het behoud van zijn rectum of slokdarm (er is immers – voorzichtig geschat – 70% kans dat volledige curatie al is bereikt). Er is ook een ‘downside’: een later tijdstip van diagnose van eventuele lokale lymfekliermetastasering of metachrone afwijkingen, of erger nog, metastases op afstand. Bij stringente endoscopische en EUS-controles lijkt de kans hierop klein en kan daarnaast voor de kleine subgroep die toch een resectie nodig blijkt te hebben door neo-adjuvante behandeling een deel van het verlies in prognose worden gecompenseerd. De beslissingen hier zijn complex en dienen per patiënt te worden gewogen en multidisciplinair te worden bediscussieerd. Ook de communicatie met patiënt en familie vereist veel extra aandacht om hen goed geïnformeerd en weloverwogen een behandelkeuze te kunnen laten maken.
Ook verschenen in de rubriek Curious Endoscopy: