Van 20-23 oktober vond in Athene het 11e congres Trends in Medical Mycology (TIMM-11) plaats. Prof. dr. Paul Verweij, hoogleraar klinische mycologie van het Radboudumc in Nijmegen én lid van de International Scientific Committee van TIMM woonde dit congres bij. Hij laat zijn licht schijnen over een aantal interessante onderwerpen en sessies die daar aan bod kwamen.
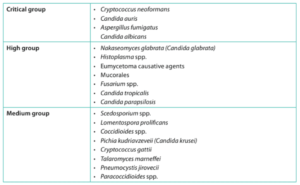
Een van de sessies ging over de prioriteitenlijst van de Wereld Gezondheidsorganisatie (WHO). Eind 2022 publiceerde de WHO een lijst met schimmels waarvan zij van mening zijn dat deze met prioriteit onderzocht moeten worden.1 “Een unicum voor de WHO”, aldus Verweij, “al is er duidelijk sprake van een trend dat er vanuit publieke gezondheidsinstanties steeds meer aandacht komt voor problematiek met schimmelinfecties.” De beschikbaarheid van antifungale middelen, met name in de Afrikaanse landen, is soms zeer ontoereikend. Sommige middelen kunnen door de slechte beschikbaarheid niet worden gebruikt. Ook is diagnostiek in deze landen een groot probleem. “Daardoor weten we niet precies welke infecties daar voorkomen en of er sprake is van resistentie”, stelt Verweij. “De WHO deed een oproep om eenvoudige testen te ontwikkelen die bij kunnen dragen aan diagnostisering van schimmelinfecties. Zeker door de relatief hoge prevalentie van hiv op het Afrikaanse continent en de verhoogde kwetsbaarheid van hiv-geïnfecteerden voor schimmelinfecties is dit een relevant aandachtspunt.”
Meer aandacht voor surveillance
Tevens wil de WHO inzetten op surveillance, iets waarvoor binnen Europa ook nog veel werk aan de winkel is. “Er lopen allerlei initiatieven om op een uniforme wijze surveillance uit te voeren om data met elkaar te kunnen vergelijken. In Nederland bestaat weliswaar een surveillance naar Aspergillus, maar deze betreft alleen de schimmel zelf zoals die in het lab wordt gekweekt. Daarbij wordt niet naar de ziektelast gekeken. Bij een schimmelinfectie is het voor de meeste laboratoria lastig om een gevoeligheidsbepaling te doen; daarom wordt het opgestuurd naar een referentielab. Bovendien, om te bepalen of een patiënt een infectie heeft, moet gekeken worden naar de gastheerfactoren en of er – naast een positieve kweek – CT-scans of andere beeldvorming nodig zijn die passen bij een schimmelinfectie.” Het stimuleren van onderzoek naar schimmels en resistentie is belangrijk omdat daar de afgelopen jaren eigenlijk te weinig in is geïnvesteerd, vindt Verweij.
C. auris in opmars
Veel aandacht was er ook voor naar een nieuwe Candida-soort, C. auris. Deze is resistent tegen azolen en soms ook tegen andere klassen antimycotica. Een voordracht vanuit Zuid-Afrika – waar de gist endemisch is en veel ziektelast veroorzaakt – illustreerde duidelijk dat men daar soms worstelt met de behandeling, mede door het ontbreken van behandelopties. “In ons land en Europa als geheel bestaat flink wat zorg over de verspreiding van C. auris. In 2022 publiceerde de Europese Centers for Disease Control and Prevention (ECDC) een onderzoek naar de prevalentie/incidentie van C. auris. In Nederland zijn een paar gevallen bekend; dit betreft dan patiënten die afkomstig zijn uit een ander land en dan hier naar de intensive care (IC) verplaatst worden.” Binnen Europa speelt het probleem voornamelijk binnen Italië, Spanje en Griekenland, de landen aan de Middellandse Zee die via deze route immigranten van het Afrikaans continent binnenkrijgen. Deze gist gedraagt zich eigenlijk meer als een bacterie, zoals MRSA. C. auris houdt zich niet alleen op in de darmen, maar ook op de huid en is daarmee behoorlijk besmettelijk. “Vooral in gezondheidsinstellingen is C. auris bij een uitbraak moeilijk onder controle te krijgen.” Verweij sprak een Duitse collega in wiens centrum een uitbraak plaatsvond. Patiënten die slechts 2 uur op een kamer met een besmette patiënt hadden gelegen bleken vervolgens zelf ook positief te zijn. “Bij overname van patiënten uit het buitenland screenen we daarom nu op C. auris; soms vinden we dat ook.” In de nieuw uit te komen richtlijn ‘Laboratoriumdetectie bijzonder resistente micro-organismen (BRMO)’ wordt C. auris ook toegevoegd.
Nieuwe diagnostische ontwikkelingen
Diagnostische ontwikkelingen betreffen onder meer nieuwe polymerase chain reaction (PCR)-testen waarmee schimmels zoals mucormycose kunnen worden aangetoond. “Tijdens de COVID-19-pandemie werd dit ook wel ‘zwarte schimmel’ genoemd, een hele ernstige schimmelinfectie die veel schade aanricht. Diagnostiek was voorheen lastig, omdat het niet altijd mogelijk was om aan goed materiaal te komen. Met deze PCR-test wordt momenteel veel onderzoek gedaan naar het aantonen van het DNA van de schimmel in het bloed. In Frankrijk heeft men voldoende patiënten kunnen verzamelen om aan te tonen dat deze PCR-test in bloed heel goed werkt. Als de DNA-test tijdens behandeling negatief wordt hebben patiënten een betere kans op overleving dan wanneer deze positief blijft.”
Lessen COVID-19
“Een van de dingen we tijdens de COVID-19-pandemie geleerd hebben, is dat pas laat aan schimmels is gedacht”, zegt Verweij. “We kennen uiteraard de klassieke risicofactoren voor patiënten met schimmels zoals leukemie, maar met COVID-19 speelt dat niet. Je moet er dus wel net aan denken dat er bij COVID-19 een schimmel kan ontstaan.” In Nederland en België was wel wat ervaring met influenza en aspergillose waardoor vrij snel werd ingezien dat dit ook een mogelijke risicofactor was. Internationaal gezien werd echter eerst naar bacteriële infecties gekeken; later bleek dat COVID-19-patiënten ook gevoelig zijn voor schimmelinfecties. Met name in het geval van aspergillose bij virale infecties is er een sterke behoefte aan snelle diagnostiek, zoals testen die binnen 1 uur uitslag geven. “Op dat gebied vindt veel ontwikkeling plaats”, stelt Verweij. “Zo zijn er point of care (POC)-testen, de lateral flow devices. Hierbij wordt bekeken of er aanwijzingen – zoals bestanddelen van de celwand – zijn voor de aanwezigheid van een schimmel. Deze testen moeten nog wel gevalideerd worden in diverse patiëntgroepen.”
Diagnose schimmels bij COVID-19 lastig
Een ander punt is dat diagnose van schimmels vooral bij COVID-19 lastig is. Verweij legt uit: “Er zijn patiënten die gekoloniseerd zijn. Bij hen zijn er aanwijzingen voor een schimmel zonder dat ze een infectie hebben. Dan heeft het zin om eerst naar de gastheer te kijken zoals we ook doen bij leukemiepatiënten. Kijk of er sprake is van een verminderde afweer, of een schimmelinfectie verwacht kan worden en of er CT-scan afwijkingen zijn die daarbij passen plus mycologische afwijkingen. Bij COVID-19 bleken de eerste 2 factoren echter niet bruikbaar. Men moest dus vooral vertrouwen op de diagnostiek.” Een van de trends was om niet 1 diagnostische marker te gebruiken, maar een aantal. Hoe meer testen positief waren, des te groter de kans op sterfte. Ook bleek het gewicht van de diverse testen verschillend.
Rol van de gastheerrespons bij COVID-19
“Een andere manier is om de gastheerrespons onder de loep te nemen”, aldus Verweij. “Dat is eigenlijk nieuw. Leukemiepatiënten zijn vaak neutropeen; er is dus weinig afweerrespons. Bij COVID-19-patiënten is dat niet zo. Mogelijk komen er stofjes vrij als een schimmel het epitheel ingroeit. Die stofjes zouden in combinatie met schimmelfactoren kunnen worden ingezet om de diagnose te stellen.” In het verlengde hiervan betekent deze werkwijze dat meer samenwerking tussen de diverse specialismen nodig is. “Infectiologen, intensivisten en microbiologen moeten hier samen aan werken om tot een optimaal protocol te komen.” Momenteel worden er zeer weinig COVID-19-infecties en schimmelinfecties op de IC’s gezien, weet Verweij. “Bij influenza zal het weer optreden, maar bij COVID-19 is het de vraag of het terugkomt en zo ja, in welke mate. Er treedt nu een verschuiving op naar patiënten die wel de onderliggende gastheerfactoren en vaak een minder goede respons op vaccinatie hebben. Zij zijn degenen die met COVID-19 op de IC komen en een invasieve aspergillose ontwikkelen.”
Klimaatverandering beïnvloedt ook schimmels
Een meer algemene zorg betreft het effect van klimaatverandering op het opkomen van nieuwe schimmel- en gistsoorten. “De gedachte is dat nieuwe soorten zich aanpassen aan hogere temperaturen; onze lichaamstemperatuur is een belangrijk afweermechanisme tegen schimmels. In een land als India waar het overdag 50 graden is, kan dat een sterke selectieprikkel zijn waardoor schimmels zich aanpassen aan hogere temperaturen en dan mogelijk mensen kunnen infecteren. Klimaatopwarming beïnvloedt zo het woongebied van de schimmel, zodat ze dat gebied kunnen koloniseren. Verweij noemt C. auris als voorbeeld: “Deze gist is op verschillende continenten tegelijkertijd opgekomen en is genetisch verschillend. Dit kan een bedreiging zijn voor de biodiversiteit als daardoor diersoorten worden weggevaagd. Denk aan bepaalde vleermuissoorten die aan schimmels ten onder kunnen gaan.” Ten slotte noemt Verweij schimmels die aan bepaalde geografische gebieden verbonden zijn, zoals histoplasmose en coccioidomycose. “Vaak komt zo’n schimmel voor in de grond en kunnen ze infecties veroorzaken bij mensen met een gewone afweer. De epidemiologie is aan het veranderen, onder andere door klimaatverandering waardoor de gebieden waar de schimmel in de natuur voorkomt groter worden. Dan zijn er andere schimmels zoals sporotrichosis dat zich in Zuid-Amerika via wilde katten sterk aan het verspreiden is. Deze schimmel kan op de mens worden overgedragen door krabben, hoesten en niezen. Bijzonder is dat als ze worden ingeademd, ze levenslang aanwezig blijven en pas jaren later bij een verminderde afweer op kunnen komen.” Daarom, zo stelt Verweij, is surveillance zo belangrijk. “Het betekent wel dat je er bijvoorbeeld als Nederlandse arts alert op moet zijn en aan de patiënt vraagt of deze misschien 30 jaar geleden in een bepaald gebied was.”
Referentie: